При ионообменной очистке из сточных вод гальванических производств удаляют соли тяжелых, щелочных и щелочноземельных металлов, свободные минеральные кислоты и щелочи, а также некоторые органические вещества.
Очистку сточных вод производят с помощью синтетических ионообменных смол (ионитов), представляющих собой практически нерастворимые в воде полимерные материалы, выпускаемые в виде гранул величиной 0,2-2 мм. В составе молекулы ионита имеется подвижный ион (катион или анион), способный в определенных условиях вступать в реакцию обмена с ионами аналогичного знака заряда, находящимися в водном растворе (сточной воде).
Ионный обмен происходит в эквивалентных отношениях и в большинстве случаев является обратимым. Реакции ионного обмена протекают вследствие разности химических потенциалов обменивающихся ионов. В общем виде эти реакции можно представить следующим образом:
mА + RmB <-> mRA + В.
Реакция идет до установления ионообменного равновесия. Скорость установления равновесия зависит от внешних и внутренних факторов: гидродинамического режима жидкости, концентрации обменивающихся ионов, структуры зерен ионита, его проницаемости для ионов. Процесс переноса вещества может быть представлен в виде нескольких стадий:
1) перенос ионов А из глубины потока жидкости к внешней поверхности пограничной жидкой пленки, окружающей зерно ионита;
2) диффузия ионов через пограничный слой;
3) переход иона через границу раздела фаз в зерно смолы;
4) диффузия ионов А внутри зерна смолы к ионообменным функциональным группам;
5) собственно химическая реакция двойного обмена ионов А и В;
6) диффузия ионов В внутри зерна ионита к границе раздела фаз;
7) переход ионов В через границу раздела фаз на внутреннюю поверхность пленки жидкости;
8) диффузия ионов В через пленку;
9) диффузия ионов В в глубь потока жидкости.
Скорость ионного обмена определяется самой медленной из этих стадий – диффузией в пленке жидкости либо диффузней в зерне ионнта. Химическая реакция ионного обмена происходит быстро и не определяет суммарную скорость процесса.
В соответствии со способностью обменивать свои подвижные ионы на катионы или анионы все иониты делятся на две группы: катиониты и аниониты. Различают сильно- н слабокислотные катиониты (в Н+ – или Na+ -форме), сильно- и слабоосновные анноннты (в ОН– – или солевой форме), а также иониты смешанного типа. К сильнокислотным относятся катиониты, содержащие сульфогруппы (SO3H) или фосфорнокислые группы [РО(ОН)2]. К слабокислотным – карбоксильные (СООН) и фенольные (С6Н5ОН) группы. Сильноосновные иониты содержат четвертичные аммониевые основания (R3NOH), слабоосновные – аминогруппы различной степени замещения (-NH2; =NH; =N).
Ионниты для очистки в гальваническом производстве
Иониты выпускают в виде порошка (размер частиц 0,04-0,07 мм), зерен (0,3-2,0 мм), волокнистого материала, листов и плиток. Крупнозернистые иониты предназначены для работы в фильтрах со слоями значительной высоты (1-3 м), порошкообразные – со слоями высотой 3-10 мм.
Ряд смол, выпускаемых в РФ, имеет произвольное наименования (Н, НО, ВС). Некоторые названия отражают состав смол: СДВ – стиролднвннилбензол; ЭДЭ – этилендиаминэтилен- хлоргидрин; МСФ – моносульфат и др. В последнее время в маркировке смол для катионитов употребляют букву К, для обозначения анионитов – А. Буква В (после А) записывается для высокоосновных анионитов, буква Н – для низкоосновных анионитов. Числовое обозначение указывает порядковый номер производственной серии. Например, КУ – катионит универсальный; КФ – катионит фосфорнокислый; АВ – анионит высокоосновной; АН – анионит низкоосновной. В табл.4.8 представлены некоторые марки ионитов и их зарубежных аналогов.
Таблица 4.8
|
Иониты загружают в фильтры различных конструкций. Наибольшее распространение получили металлические ионообменные фильтры (диаметр 2,6 м), серийно выпускаемые Таганрогским заводом “Красный котельщик” и Бийским котельным заводом.
Очистка сточных вод в режиме последовательного фильтрования
Ионообменную очистку сточных вод обычно осуществляют путем их последовательного фильтрования через катиониты (в Реформе) и аниониты (в ОН-форме). В некоторых случаях для очистки водных растворов применяют иониты в солевой форме (например, катиониты в Nа+-форме, аниониты в Cl -форме ). При наличии в воде анионов сильных и слабых кислот анионирование ведут в две ступени, извлекая сначала анионы сильных кислот на слабоосновных анионитах, а затем анионы слабых кислот на сильноосновных анионитах.
В процессе очистки сточных вод происходит насыщение ионитов катионами и анионами по следующим реакциям:
фильтр катионитовый
n R-H + Men+ -» Rn–Me + n Н+
сорбция
Rn–Me + nН+ -» n R-H + Меn+
регенерация фильтр анионитовый
n R-OH + Аnn -» Rn-An + nОН–
сорбция
Rn–Аn + п NaOH -» n R-OH + NanAn
регенерация
Поглотительная способность ионитов характеризуется обменной ёмкостью, которая определяется числом эквивалентов ионов, поглощаемых единицей массы или объёма ионита. Различают полную, статическую и динамическую обменные ёмкости. Полная ёмкость – это количество поглощаемого вещества при полном насыщении единицы объёма или массы ионита. Статическая ёмкость – это обменная ёмкость ионита при равновесии в данных рабочих условиях. Статическая обменная ёмкость обычно меньше полной. Динамическая обменная ёмкость – это ёмкость ионита до “проскока” ионов в фильтрат, определяемая в условиях фильтрации. Динамическая ёмкость меньше статической.
Обменная ёмкость сильнокислотных катионитов и сильноосновных анионитов по отношению к различным ионам остается постоянной в широком интервале значений pH. Обменная емкость слабокислых катионитов и слабоосновных анионитов в большой степени зависит от величины pH и максимальна для первых в щелочной среде (рН>7), а для вторых – в кислой среде (рН<7).
Иониты в контакте с водой не растворяются, но поглощают некоторое количество воды и набухают. При набухании объем ионитов увеличивается в 1,5-3 раза. Степень набухания зависит от строения смолы, природы противоионов, от состава раствора. Сильно набухающие смолы, называемые гелеобразными, имеют удельную обменную поверхность 0,1-0,2 м2/г. Макропористые иониты обладают развитой обменной поверхностью, равной 60-80 м2/г. Синтетические иониты набухают в воде больше и имеют большую обменную емкость, чем природные. Срок службы синтетических катионитов значительно больше, чем анионитов. Это объясняется низкой стабильностью групп, которые в анионитах выполняют роль фиксированных ионов.
Селективность обмена зависит от величины давления набухания в порах смолы и от размера пор ионита. При малом размере пор большие ионы не могут достичь внутренних активных групп. В целях повышения селективности ионитов к определенным металлам в состав смол вводят вещества, способные образовывать с ионами этих металлов внутрикомплексные соединения (хелаты). Установлены ряды ионов по энергии их вытеснения из сильно- и слабокислотных катионитов. Например, для сильнокислотного сульфокатионита КУ-2 получен следующий ряд: H+<Na+<NH4+<Mg2+<Zn2+<Co2+<Cu2+<Cd2+<Ni2+<Ca2+<Sr2+<Pb2+< Ва2+. Для слабокислотного катионита КБ-4: Mg2+<Ca2+<Ni2+<Co2+<Cu2+ .
Регенерация насыщенных ионитов
Насыщенные иониты подвергают регенерации, перед которой их взрыхляют очищенной водой с интенсивностью 3-5 л/(см2). Регенерацию катионитов осуществляют 2-8 %-ными растворами минеральных кислот, регенерацию анионитов – 2-6 %-ными растворами едких щелочей. После регенерации проводят отмывку ионитов.
Растворы, образующиеся при регенерации ионитов (элюаты), подвергают дальнейшей переработке с целью утилизации содержащихся в них ценных химических продуктов или нейтрализации.
Принципиально возможны три варианта ионообменной очистки сточных вод гальванических производств:
- очистка сточных вод, образующихся в отдельных технологических процессах – локальная очистка;
- очистка общего стока гальванического цеха или участка;
- очистка сточных вод, подвергнутых предварительному обезвреживанию с помощью химических реагентов для удаления из них минеральных солей.
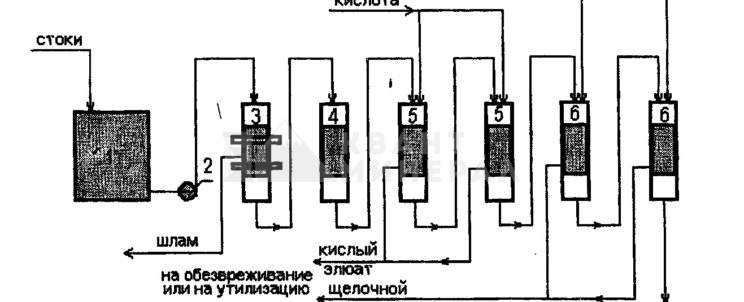
На рис. 4.5 представлена принципиальная схема очистки промывных и сточных вод ионообменным методом при начальной концентрации ионов тяжелых металлов до 300 мг/л.
С экономической точки зрения наиболее целесообразна ионообменная очистка не общего стока гальванического цеха, а локальная очистка. В этом случае переработка и возврат в производство концентрированных растворов, образующихся при регенерации ионитов и содержащих различные химические продукты, вызывает наименьшие трудности.
Ионообменный метод применим в основном для очистки сточных вод с общим солесодержанием до 3 г/л. Увеличение солесодержания воды снижает экономичность способа из-за снижения продолжительности межрегенерационного цикла работы ионитов и повышения расхода химикатов на их регенерацию.
Рис. 4.5.Принципиальная схема очистки промывных и сточных вод ионообменным методом: 1-накопитепь стоков, 2-насос, 3-механический фильтр, 4-сорбционный фильтр, S-фильтры катионитовые, 6-фильтры анионитовые.
Ионы цинка извлекают на сильнокислотном сульфокатионите КУ-2-8 в Н-форме или на карбоксильном катионите КБ-4 в Na- форме. Динамическая обменная емкость по Zn2+ катионита КУ-2 равна 2-3, а КБ-4 5 г-экв/кг. Сильнокислотные катиониты извлекают ионы цинка в широком диапазоне значений pH. Карбоксильные катиониты применяют при очистке нейтральных или слабощелочных сточных вод. Регенерацию , сульфокатионитов производят 10 %-ным раствором серной кислоты; карбонильные катиониты регенерируют 5 %-ным раствором Na2SC>4. Концентрация цинка в элюатах составляет 6-9 г/л.
Другие вещества для очистки в гальваническом цеху
Ионы меди извлекают из сточных вод катионитом КУ-1 при рН=12-12,4. Обменная емкость катионита равна 1,7-2,3 г-экв/кг набухшей смолы. Регенерацию проводят 5 %-ным раствором НС1. Концентрация меди в элюатах достигает 15-17 г/л. Из кислых сточных вод медь извлекают сильнокислотными катионитами. Их регенерируют 10-20 %-ным раствором серной кислоты.
Ионы никеля извлекают из воды на катионите КУ-2-8, динамическая объемная емкость которого равна 2,1-2,4 г-экв/кг катионита. Скорость фильтрования сточных вод 12-15 м/ч. Регенерацию проводят 20 %-ным раствором серной кислоты со скоростью 0,5 м/ч. Полученные элюаты содержат 95 г/л никеля и их можно возвращать в ванну никелирования.
Для удаления из сточных вод катионов трехвалентного хрома Сг3+ применяют Н-катиониты, а хромат-ионы СЮ42‘ и бихромат- ионы Сr2О72- извлекают на анионитах АВ-17, АН-18П, АН-25. Емкость анионитов по хрому не зависит от величины pH в пределах от 1 до 6 и значительно снижается с увеличением pH более 6. Скорость фильтрования принимают равной 10-15 м/ч.
Регенерацию сильноосновных анионитов проводят 8-10 %- ным раствором едкого натра. Элюаты, содержащие 40-50 г/л шестивалентного хрома, могут рекуперироваться. Скорость фильтрования при регенерации составляет 1-1,5 м/ч.
Простые и комплексные цианиды извлекаются на анионитах: сточные воды с щелочной реакцией обрабатывают анионитами в солевой форме, нейтральные и слабокислые воды – анионитами в гидроксидной и солевой форме. Поглощение цианидов из щелочных сточных вод анионитами в солевой форме (например, в С1-форме) происходит по следующим реакциям обмена:
RC1 + ОН– -» ROH + С1–
RC1 + CN– -» RCN + С1–
mRCl + [Me(CN)n]m -» RmMe(CN)n + mCl–
Сорбция цианидов из нейтральных и слабокислых сред анионитами в солевой форме происходит в соответствии с уравнениями:
RC1 + CN– -» RCN + С1–
mRCl + [Me(CN)n]m -» RmMe(CN)n + mCl-,
а поглощение анионитами в гидроксильной форме происходит по уравнениям:
ROH + CN- -> RCN + ОН
mROH + [Me(CN)n]m -> RmMe(CN)n + mOH–
При сорбции цианидов смолами в солевой форме из нейтральных или слабокислых стоков одним из продуктов реакции обмена является синильная кислота:
RC1 + HCN –» RCN + НС1,
которая полностью сдвигает равновесие обмена влево и взаимодействия между анионитом и синильной кислотой не происходит. В то же время сорбция цианидов из нейтральных или слабокислых сред анионитами в гидроксильной форме идет с образованием воды, поэтому емкость анионитов в гидроксильной форме выше, чем в солевой. При высоком значении pH исходную воду перед подачей на анионит подвергают Н-катионированию.
Сильноосновной анионит регенерируют 5-10 %-ным раствором едкого натра или хлоридом натрия. Регенерация происходит не полностью (простые цианиды десорбируют на 80- 90%, а комплексные – на 42-78 %). Для более полной регенерации требуется значительный расход регенерирующих растворов.