Физико-химические обоснования метода коагуляции в гальванике
Электрокоагуляция как метод превращения примесей в гальваническом производстве в грубодисперсное состояние основывается на множестве физико-химических процессов, протекающих в жидкости под воздействием электрического тока:
- электростатическая (поляризационная) коагуляция – диполь- дипольное взаимодействие коллоидных частиц за счет дальнодействующих сил притяжения, возникающих при наложении электрического поля;
- электрохимическая коагуляция – взаимодействие частиц при изменении их заряда или толщины двойного электрического слоя за счет изменения физико-химических свойств раствора (pH и Eh) в межэлектродном объёме или приэлектродных слоях;
- электролитическая коагуляция – взаимодействие частиц при введении потенциалообразующих ионов металлов за счет электрохимического растворения электродов;
- гидродинамическая коагуляция – слипание частиц за счет
увеличения числа их столкновений при перемешивании жидкости в электролизере (перемешивание жидкости может осуществляться как продуктами электрохимических реакций, так и за счет
конструктивных приемов);
концентрационная коагуляция – увеличение числа столкновений частиц, приводящих к их слипанию, за счет повышения локальных концентраций частиц в межэлектродном объёме при их транспорте, осаждении на электродах и т.п.
Электрокоагуляционный метод применяют в основном для очистки хромсодержащих сточных вод в гальванике.
В результате электролитического растворения стальных анодов при рН>2 образуются ионы Fe2+ по следующей схеме:
- Fe + ОН– <—> FeOH+ (аде) + е–;
- FеОН+(адс)+ ОН– <—> Fе(ОН)2(адс);
- Fе(ОН)2(адс) <—> Fe(OH)2(водн);
- Fe(OH)2(водн) <—> FeOH+ + OH–;
- FeOH+ <—> Fe2+ + OH–.
Две концепции метода коагуляции в гальваническом производстве
В настоящее время существуют две основные концепции теоретического обоснования механизма коагуляции, обусловленной введением положительных многозарядных ионов железа, гидролизующихся в воде с образованием гидроксидов и других промежуточных соединений:
- специфическая сорбция многозарядных ионов (Al3+, Fe3+, Fe2+ и др.) на частицы с последующим изменением заряда её поверхности, что приводит к коагуляции;
- образование малорастворимых соединений ионов металла с компонентами раствора, которые взаимодействуют с коллоидными частицами, имеющими противоположный заряд поверхности.
Необходимо отметить, что обе концепции теоретически и экспериментально недостаточно обоснованы. Однако многочисленными экспериментами доказано, что скорость коагуляции значительно выше при формировании малорастворимых соединений. Можно предположить преимущественное влияние адгезионного механизма взаимодействия противоположно заряженных поверхностей частиц и гидроксидов. Исходя из этого процесс электрокоагуляции можно разделить на следующие стадии: генерация ионов металла на поверхности электрода; миграция ионов металла с поверхности в объём раствора; образование малорастворимых соединений металла с компонентами раствора; адгезия коллоидных частиц примесей и образовавшихся малорастворимых соединений.
Восстановление Сг6+ до Сг3+ в гальванических производствах
Одновременно этими процессами ионы Fe2+, а также гидроксид железа (II), способствуют химическому восстановлению Сг6+ до Сг3+ по реакциям:
при рН< 5,5 Сг2O72- + 6Fe2+ + 14Н+ -> 6Fe3+ + 2Сг3+ + 7H2О
при рН>= 5,5 Cr2O72 +3Fe(OH)2+4H2O -> 3Fe(OH)3+2Cr(OH)3+2OH . Некоторое количество СгОд2- и СггСЬ2- -ионов восстанавливается до ионов Сг3+ в результате катодных электрохимических процессов:
катод Сг2O72- + 14Н+ + 6е– -> 2Сг3+ + 7Н20
Сг2O72- + 4Н2O + Зе– -> 2Сг(ОН)3 + 5OН–
При электрохимической обработке сточных вод происходит их подщелачивание, что способствует коагуляции гидроксидов железа (II) и (III) и хрома (III), а также гидроксидов других тяжелых металлов, ионы которых могут содержаться в сточных водах гальванических производств.
Гидроксиды металлов образуют хлопья, на которых происходит адсорбция других примесей, содержащихся в сточных водах. Прирост величины pH может составлять 1-4 единицы.
Способ наиболее целесообразно применять при исходной концентрации Сг6+ в сточных водах менее 150 мг/л и исходном солесодержании более 300 мг/л.
Оптимальные значения pH при обезвреживании хромсодержащего стока совместно с кисло-щелочными водами находятся в зависимости от концентрации хрома и присутствующих ионов тяжелых металлов (табл. 4.4). При этом суммарная концентрация ионов тяжелых металлов не должна превышать 100 мг/л, а концентрация каждого из них – 30 мг/л. Необходимо иметь в виду, что даже при соблюдении оптимальных условий очистки сточных вод остаточное содержание в них ионов тяжелых металлов может превышать установленные нормы сброса, в связи с чем в технологической схеме следует предусматривать возможность доочистки введением щелочных реагентов с целью повышения pH до pH гидратообразования тяжелых металлов.
Таблица 4.4
Оптимальные значения pH хромсодержащих стоков
| Концентрация Cr (VI), | При наличии Zn2+ | При наличии Ni2+ |
| Менее 20 | 6-7 | 6-7 |
| 20-50 | 5-6 | 6-7 |
| 50-150 | 4-6 | 5-6 |
Содержащиеся в сточных водах ионы NO2- NO3-, СО32-, РО43 при проведении процесса электролиза вызывают пассивацию поверхности анодов. Для активации анодов добавляют хлорид натрия, при этом рекомендуется поддерживать в стоке соотношения анионов, указанные в табл.4.5. Ультразвуковая очистка электродов, вибрация, встряхивание, высокая скорость движения воды в межэлектродном пространстве при напорном режиме или за счет рециркуляции, однопоточная схема движения воды, механическая чистка электродов скребками, продувка межэлектродного пространства газом, вращающийся растворимый электрод и другие меры снижают опасность пассивации анодов.
Использование электричество для восстановления хрома
Полнота восстановления Сг6+ до Сг3+ и продолжительность обработки стоков зависит от интенсивности растворения железных анодов, которая в свою очередь определяется количеством пропущенного электричества. Теоретический расход электричества на восстановление 1 г Сг6+ составляет:
0,96 х 3,22 = 3,08 (А*ч)
где 0,96 – количество электричества, затрачиваемое на растворение 1 г металлического железа, А*ч;
3,22 – количество Fe2+ в граммах, необходимое для восстановления 1 г Сг6+ в соответствии с уравнением реакции.
Теоретические расходы железа и электричества для обработки 1 м3 сточных вод гальванического цеха с различной концентрацией Сг6+ можно определить по табл.4.6.
Таблица 4.6
|
Теоретические расходы железа и электричества
|
Удельный расход металлического железа и расход электричества для обезвреживания соответствующих ионов тяжелых металлов приведены в табл. 4.7.
Расход металлического железа, необходимый для обработки сточных вод, определяется, в основном, содержанием катиона металла, для удаления которого должно быть затрачено наибольшее количество металлического железа.
При обработке общего стока гальванического цеха, в котором содержание Сг6+ значительно превышает содержание ионов других тяжелых металлов, как правило, достигается высокая степень очистки и от ионов этих металлов при расходе электроэнергии и металлического железа в количествах, необходимых только для удаления из сточных вод Сг6+. В тех случаях, когда в общем стоке гальванического цеха соединения шестивалентного хрома не преобладают, достаточно высокая степень очистки сточных вод от ионов тяжелых металлов достигается при исходной величине pH сточных вод, близкой к величине pH начала образования соответствующих гидроксидов металлов, а также при условии перевода в раствор определенного количества железа.
Таблица 4.7
Удельные расходы железа и электричества
| Металл | Расход железа, г/г удаляемого металла | Теоретический расход электричества, А-ч/г удаляемого металла |
| Цинк (Zn2+) | 2,5-3,0 | 2,30-2,88 |
| Медь (Cu2+) | 3,0-3,5 | 2,88-3,36 |
| Кадмий (Cd2+) | 4,0-4,5 | 3,84-4,32 |
| Никель (Ni2+) | 5,5-6 | 5,30-5,75 |
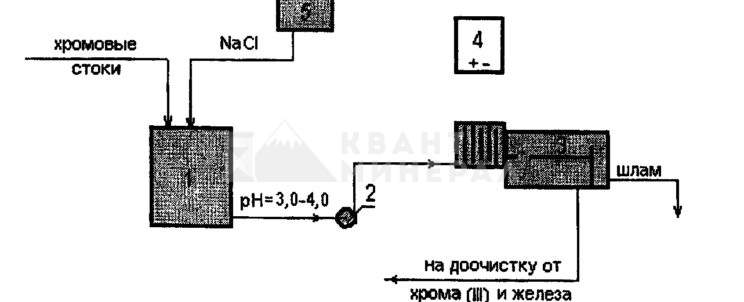
На рис. 4.3 представлена принципиальная схема электрокоагуляционной очистки.
Использование электрокоагулятора при очистке в гальванических производствах
Электрокоагулятор включает в себя две секции: пластинчатый электролизер вертикального исполнения с подводом очищаемой воды снизу вверх и осветлитель.
Электролиз проводят при следующих параметрах: плотность тока на аноде 0,6-1,5 А/дм2 для концентрированных вод и 0,15-0,8 А/дм2 для разбавленных (>100 мг/л) стоков, напряжение на электродах 12-24 В (при солесодержании менее 500 мг/л), 6-12 В (при солесодержании более 500 мг/л); продолжительность обработки 60 – 180 с; материал электродов – низкоуглеродистая сталь (Ст.З, Ст.4 и др.); толщина электродов 3-8 мм; расстояние между электродами 6- 12 мм. Процесс электрокоагуляции может быть значительно интенсифицирован при повышении температуры обрабатываемой воды до 60-80 °С и анодной плотности тока 2-2,5 А/дм2. При этом твердая фаза гидроксидов меняет свою структуру и приобретает ферромагнитные свойства. При электрокоагуляции фторсодержащих сточных вод применяют алюминиевые электроды. В последние годы предложено несколько конструкций электролизеров с засыпными анодами из отходов металлообработки.
В качестве осветлителя в гальваническом производстве используют отстойники, флотаторы- отстойники, флотаторы-осветлители. Так как в электродной секции происходит усиленное насыщение воды пузырьками выделяющегося водорода, то в осветлителе часть скоагулированной твердой фазы всплывает на поверхность воды, а часть оседает на дно. Для уменьшения объёма осадка и ускорения процесса осветления в обрабатываемую воду добавляют раствор полиакриламида в количестве 30 мг/л.
Рис.4.3. Принципиальная схема электрокоагуляционной очистки: 1-накопитель хромсодержащих стоков, 2-иасос, 3-электрокоагулятор, 4-выпрямитель, 5-дозатор раствора хлорида натрия
При соблюдении указанных условий и исходной концентрации каждого из ионов тяжелых металлов, не превышающей 30 мг/л, степень очистки от них сточных вод составляет 90-95%. После 24-часового уплотнения объем осадка уменьшается на 20-30%, влажность его при этом достигает 98,2- 98,5%.
При необходимости осуществляют доочистку от ионов тяжелых металлов обработкой щелочными реагентами (см. п.4.1.1 – метод нейтрализации) с последующей фильтрацией на песчаных и пенополистирольных фильтрах.